Şizofreni, Otizm Spektrum Bozukluğu (OSB) ve Entelektüel Yetiyitimi (EY) gibi nörogelişimsel ve psikiyatrik hastalıklar, karmaşık ve çok faktörlü etiyolojilere sahiptir. Bugüne kadar yapılan çalışmalar, bu hastalıkların kalıtımının büyük bir kısmının yüzlerce hatta binlerce ortak gen varyantının kümülatif etkisiyle ilişkili olduğunu öne sürmüştür [1, 2]. Ancak son dönemde yapılan ve Nature Genetics’te yayınlanan yeni bir çalışma [3], nadir genetik varyantların, özellikle protein fonksiyonunu tamamen bozan (null varyantlar), bu hastalıklara beklenenden çok daha yüksek risk atfedebileceğini gösteriyor.
Makalemiz [3], nöronal işlev için kritik olan bir reseptör alt birimini kodlayan GRIN2A genindeki null varyantların erken başlangıçlı şizofreni ve diğer zihinsel bozukluklar için ne kadar güçlü bir risk faktörü olduğunu detaylıca ortaya koyuyor. Bu bulgular, zihinsel hastalıklarda Hassas Tıp (Precision Medicine) yaklaşımının önünü açabilir.
1. GRIN2A: Nöronal İletişimin Anahtarı
GRIN2A geni, beyindeki önemli eksitatör nörotransmitterlerinden birisi olan glutamatın ana reseptörlerinden birisi N-metil-D-aspartat (NMDA) reseptörünün bir alt birimini (GluN2A) kodlar [4].
• NMDA Reseptörleri: Sinaptik plastisite, öğrenme ve hafıza gibi temel nörobiyolojik süreçler için hayati öneme sahiptir.
• GRIN2A Varyantları: GRIN2A‘daki fonksiyon kaybına yol açan varyantlar daha önce epilepsi ve gelişimsel ensefalopatilerle ilişkilendirilmişti [5]. Ancak bu çalışma, bu varyantların doğrudan psikiyatrik bozukluklarla olan güçlü ilişkisini sistematik olarak gösteriyor [3].
Bu görselde NMDA reseptörünün yapısı ve GRIN2A geni tarafından kodlanan GluN2A alt biriminin (kırmızı ile gösterilebilir) reseptör kompleksi içindeki konumu gösterilerek, genin temel biyolojik rolü açıklanabilir. (Referans: Genel NMDA reseptör yapısı, [4]).
2. Makalenin Temel Bulguları: Yüksek Penetranslı Risk
Makale [3], GRIN2A genindeki fonksiyon kaybı (Loss-of-Function, LoF) varyantlarının, özellikle erken başlangıçlı şizofreni için istatistiksel olarak anlamlı bir şekilde temsil edildiğini gösterdi.
• Risk Oranı (Odds Ratio): GRIN2A null varyantlarını taşıyan bireylerde erken başlangıçlı şizofreni riskinin, genel popülasyona kıyasla çarpıcı derecede yüksek olduğu belirlendi. Bu, klasik poligenik risk skorlarının tek başlarına açıklayamayacağı, yüksek penetranslı bir genetik etkiyi işaret ediyor [3].
• Fenotipik Spektrum: GRIN2A null varyantları, sadece şizofreni ile değil, aynı zamanda OSB ve EY ile de güçlü bir ilişki göstererek, genetik kusurların geniş bir nörogelişimsel spektrumu tetikleyebileceğini ortaya koydu [3].
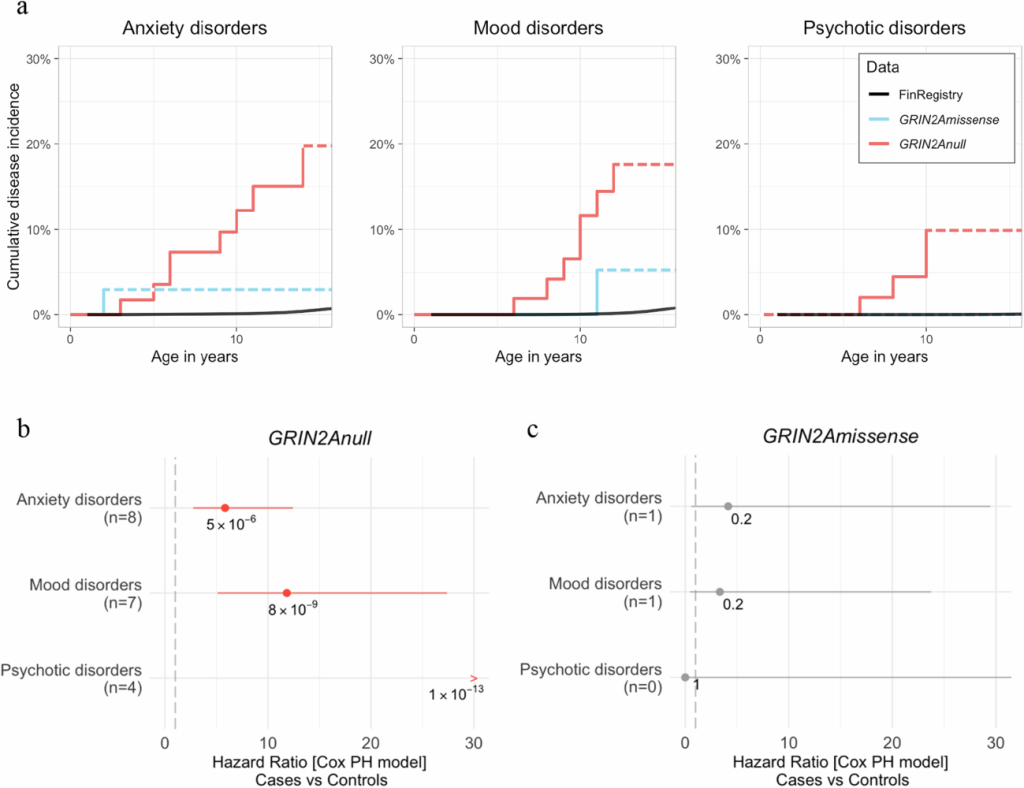
Bu veri, GRIN2A null varyantlarının erken başlangıçlı şizofreni riskini ~10 kat veya daha fazla artırabileceğini gösteren makalenin ana bulgusudur [3].
3. Klinik Çıkarımlar ve Hassas Tedavi Potansiyeli
Bu keşfin en heyecan verici yanı, tanısal olmanın yanı sıra, terapötik (tedaviye yönelik) potansiyelidir. NMDA reseptörlerinin işlev kaybından kaynaklanan bir hastalık için, hedefe yönelik tedavi geliştirme imkanı doğmaktadır.
• NMDA Reseptör Agonistleri/Modülatörleri: GRIN2A null varyantı taşıyan hastalarda, NMDA reseptörünün aktivitesini artıran (agonist) veya modüle eden (pozitif allosterik modülatör) bileşikler, reseptör fonksiyonundaki eksikliği teorik olarak giderebilir [6].
• İlaç Tarama ve Yeniden Konumlandırma: Var olan ilaç kütüphaneleri, GRIN2A disfonksiyonunun neden olduğu nöronal fenotipi in vitro (hücre kültürü) veya in vivo (hayvan modelleri) ortamda düzeltebilecek moleküller için taranabilir. Bu, tedavi geliştirme sürecini dramatik şekilde hızlandırabilir [7].
Kanser Tedavilerine Benzerlik: Genomik Tanıdan Hassas Tedaviye
Tıpkı onkolojide BRAF mutasyonu taşıyan kanserlerin spesifik BRAF inhibitörleriyle tedavi edilmesi gibi [8], nöropsikiyatride de GRIN2A gibi yüksek penetranslı varyantlar taşıyan hastaların, NMDA reseptör modülatörleri gibi hedefe yönelik ilaçlarla tedavi edilmesi hedeflenebilir.
4. Gelecek
Bu çalışma, psikiyatrik genetik alanındaki ana trendlerden birini teyit etmektedir: Nadir varyantlar, karmaşık hastalıklarda tedavi edilebilir alt grupları (endofenotipleri) tanımlamada kritik öneme sahiptir [9, 10].
• Rutin Genetik Tarama: Erken başlangıçlı veya atipik seyirli nörogelişimsel/psikiyatrik bozuklukları olan hastalarda, GRIN2A ve benzeri yüksek riskli genlerin (örneğin SCN2A, TBR1) rutin genetik panellere dahil edilmesi gerekliliği güçlenmektedir.
• NMDA Tedavileri: Klinik denemeler, GRIN2A varyantı taşıyıcılarında agonist veya modülatör yaklaşımların etkinliğini kanıtladığında, bu varyantlar hızla tanısal bir biyobelirteçten teranostik (tedaviye yönelik tanı) bir biyobelirtece dönüşecektir.
Bu genomik devrim, zihinsel hastalıkların teşhis ve tedavisinde ezber bozan bir değişimin sinyalini veriyor. Artık genel semptomları değil, hastalığın temelindeki moleküler arızayı hedefleyebiliriz.
Sizce, zihinsel hastalıklarda genetik testlerin yaygınlaşması, teşhis ve tedavi kılavuzlarını ne kadar sürede yeniden yazdıracak?
Yazar: Akın Sevinç
Editör: Umut Batuhan Sarı
Referanslar (Endüstri Standardı Makaleler):
1. Visscher, P. M., Wray, N. R., Zhang, Q., et al. (2017). 10 Years of GWAS Discovery: Biological Insights and Clinical Applications. Am J Hum Genet, 101(4), 515-523.
2. Purcell, S. M., et al. (2009). Common variants at 12q24 and 10p15 affect risk of schizophrenia. Nature, 460(7251), 74-78.
3. Lemke, J. R., Eoli, A., Krey, I., et al. (2025). GRIN2A null variants confer a high risk for early-onset schizophrenia and other mental disorders and potentially enable precision therapy. Molecular Psychiatry.
4. Paoletti, P., Bellone, C., & Zhou, Q. (2013). NMDA receptor subunit composition and synaptogenesis: an evolutionary perspective. Curr Opin Neurobiol, 23(1), 4-15.
5. Lesca, G., et al. (2013). De novo GRIN2A mutations in epilepsy and intellectual disability. Nat Genet, 45(9), 1084-1087.
6. Gao, W. F., et al. (2021). The therapeutic potential of NMDA receptor modulators for neuropsychiatric disorders. Pharmacol Ther, 223, 107817.
7. Hyman, S. E. (2013). Revolutionizing the diagnosis and treatment of mental illnesses. JAMA, 310(14), 1435-1436.
8. Davies, H., et al. (2002). Mutations of the BRAF gene in human cancer. Nature, 417(6892), 949-954.
9. Walsh, T., et al. (2008). Rare structural variants disrupt genes implicated in autism and schizophrenia. Science, 320(5883), 539-543.
10. Satterstrom, F. K., et al. (2020). Large-scale exome sequencing study identifies new risk genes for autism. Cell, 180(3), 568-586.